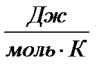Часть I
1. Заполните таблицу «Характеристика элемента на основании его положения в Периодической системе (ПС) Д. И. Менделеева» на примере элемента кальция.
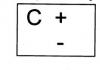
2. Подтвердите характер оксида кальция соответствующими уравнениями реакций, в том числе и ионными, для реакций с участием электролитов:
3. Подтвердите характер гидроксида кальция соответствующими уравнениями реакций в молекулярной, полной и сокращённой ионной формах:

Часть II
1. Вычеркните «лишнее».
4) Si
2. Какая из следующих групп элементов содержит только металлы?
Нет правильного варианта ответа.
3. Какая из характеристик металлической связи является неточной?
Металлическая связь:
1) характеризуется ненаправленностью;
2) характеризуется ненасыщенностью.
4. Какое физическое свойство не является общим для всех металлов?
3) твёрдое агрегатное состояние при стандартных условиях.
5. Дайте характеристику элемента лития согласно приведённому в части I плану.
1) Это элемент I A группы, 2-го малого периода.
2) +3Li 2е, 1е.
3) Li – сильный восстановитель, который получает с. о. +1.
4-5) Li – это металл, поэтому имеет металлическую кристаллическую решётку, образованную за счёт металлической химической связи, схема которой:
6) аллотропия для лития нехарактерна.
7) Металлические свойства у лития выражены больше, чем у бериллия.
8) Металлические свойства у лития выражены больше, чем у водорода, но меньше, чем у натрия.
9) Оксид лития имеет основный характер и взаимодействует:
с кислотными оксидами;
с кислотами;
с водой.
10) Гидроксид лития LiOH имеет основный характер и является растворимым основанием – щёлочью. Взаимодействует (напишите уравнения возможных реакций в молекулярной, полной и сокращённой ионной формах):
6. Металлы (М) IА группы, или щелочные металлы, образуют водородные соединения с общей формулой МН.
В этих соединениях, в отличие от летучих водородных соединений неметаллов, связь ионная и кристаллическая решётка ионная.
Эти бинарные соединения проявляют следующие физические свойства:
Белые кристаллические вещества, похожие на соль.
7. Металлы IIA группы (начиная с Са) – щелочноземельные металлы – образуют водородные соединения с общей формулой .
Они называются гидридами, имеют ионную кристаллическую решётку, построенную за счёт ионной химической связи, и обладают следующими физическими свойствами: белые солеподобные кристаллические вещества.
При взаимодействии с водой наблюдается реакция обмена.
Характеристика химического элемента-металла на основании его положения в Периодической системе Д. И. Менделеева
Цели урока. Дать план общей характеристики химического элемента по его положению в Периодической системе и научить девятиклассников использовать его для составления характеристики элемента-металла. Повторить на основе этого сведения по курсу 8 класса о строении атома, о типах химической связи, о классификации неорганических веществ и их свойствах в свете ТЭД и ОВР, о генетической связи между классами соединений. Познакомить учащихся с решением задач на долю выхода продукта реакции.
Оборудование и реактивы. Li, Li 2 O, LiOH; СаСО 3 и HNО 3 для получения СО 2 ; растворы:CuSО 4 , NH 4 Cl, НСl, фенолфталеина; пробирки, прибор для получения газов.
I. План характеристики химического элемента по его положению в Периодической системе
В отличие от плана, приведенного в учебнике, очевидно, будет логичным начать общую характеристику элемента именно с определения его «координат», т. е. положения в Периодической системе. Учащиеся очень часто этот пункт плана называют просто: «адрес химического элемента», т. е. указывают порядковый номер элемента, период (называется его тип: малый или большой) и группу (указывается тип подгруппы: главная или побочная). При выполнении этого пункта плана характеристики будет верным, если учитель введет и новые обозначения типа подгруппы: А - для главной и В (Б) - для побочной, что вызвано использованием такой символики в тестах и формулировках билетов выпускных экзаменов за курс основной и средней школы.
В учебнике приведен сокращенный вариант характеристики магния. Раскроем более подробно характеристику другого химического элемента-металла - лития.
II. Характеристика химического элемента лития по его положению в Периодической системе
1. Литий-это элемент 2 периода главной подгруппы I группы Периодической системы Д. И. Менделеева, элемент IA группы или (если учащиеся вспомнят курс восьмого класса) подгруппы щелочных металлов.
2. Строение атома лития можно отразить так:
Будет правильным, если здесь ученики охарактеризуют первую форму существования химического элемента - атомы.
Атомы лития будут проявлять сильные восстановительные свойства: легко отдадут свой единственный внешний электрон и получат в результате степень окисления (с. о.) + 1. Эти свойства атомов лития будут слабее выражены, чем у атомов натрия, что связано с увеличением радиусов атомов:
Учителю можно обратить внимание на проблему: почему же в электрохимическом ряду напряжений литий стоит впереди натрия. Все дело в том, что ряд напряжений характеризует не свойства атомов, а свойства металлов - простых веществ, т. е. второй формы существования химических элементов, для которой существенную роль играет не R aт , а параметры другого рода: энергия связи кристаллической решетки, стандартные электродные потенциалы и т. д.
Восстановительные свойства атомов лития выражены сильнее, чем у его соседа по периоду - бериллия, что связано и с числом внешних электронов, и с R aт .
3. Литий - простое вещество, представляет собой металл, а следовательно, имеет металлическую кристаллическую решетку и металлическую химическую связь (учитель повторяет с учениками определения этих двух понятий), образование которой можно отразить с помощью схемы:

Учитель обращает внимание на то, как записывается заряд иона лития: не Li +1 (так указывают с. о.), a Li + .
По ходу этой характеристики повторяются также и общие физические свойства металлов, вытекающие из их кристаллического строения: электро- и теплопроводность, ковкость, пластичность, металлический блеск и т. д.
4. Литий образует оксид с формулой Li 2 О.
Учитель повторяет с учащимся состав и классификацию оксидов, в результате чего ученики сами формулируют, что Li
2
0 - это солеобразующий, основный оксид. Это соединение образовано за счет ионной химической связи (почему?; учитель просит записать схему образования этой связи:
 ) и, как и все основные оксиды, взаимодействует с кислотами, образуя соль и воду, и с кислотными оксидами, а также с водой, образуя щелочь. Ученики называют тип соответствующих реакций, записывают уравнения их, а реакцию с кислотами рассматривают также и в ионном виде.
) и, как и все основные оксиды, взаимодействует с кислотами, образуя соль и воду, и с кислотными оксидами, а также с водой, образуя щелочь. Ученики называют тип соответствующих реакций, записывают уравнения их, а реакцию с кислотами рассматривают также и в ионном виде.
5. Гидроксид лития имеет формулу LiOH. Это основание, щелочь.
Учитель повторяет с учащимися два блока сведений теоретического характера по материалу прошлого года: строение и свойства LiOH.
Строение. Учащиеся сами называют тип связи между Li + и ОН - - ионный, говорят о том, что Li + - простой ион, а ОН - - сложный. Тогда учитель просит определить тип связи между атомами кислорода и водорода в гидроксид-ионе. Ребята без труда называют его: ковалентная полярная связь. И тогда учитель подчеркивает, что наличие разных типов связи в одном веществе - аргумент в пользу утверждения о том, что деление химических связей на разные типы относительно, все связи имеют единую природу.
Химические свойства: взаимодействие с кислотами, кислотными оксидами и солями - рассматриваются в свете ТЭД и иллюстрируются уравнениями реакций в ионной и молекулярной формах (лучше именно в этом порядке).
6. Для характеристики водородного соединения (ее можно дать только в сильном классе) лучше использовать проблемную ситуацию: почему в горизонтальной графе «Летучие водородные соединения» в подгруппе щелочных металлов отсутствует общая формула?
Учащиеся резонно отвечают, что, это очевидно, так как эти металлы не образуют летучих водородных соединений. Учитель в ответ спрашивает: а какие соединения могут дать эти металлы с водородом? На это учащиеся довольно часто отвечают, что, наверное, бинарные соединения ионного типа с формулой М + Н - . Тогда учитель может завершить эту часть характеристики обоснованием вывода о том, что водород вполне законно занимает в Периодической системе двойственное положение: и в IA группе, и в VIIA группе.
III. Решение задач на нахождение доли выхода продукта реакции от теоретически возможного
Первая часть урока посвящена применению теоретических знаний за курс восьмого класса для описания свойств конкретного химического элемента. Это, так сказать, качественная сторона повторительно-обобщающего урока, вводного в курс химии элементов.
Количественная сторона такого урока может быть представлена расчетами, связанными с таким обобщающим понятием, как «доля выхода продукта реакции от теоретически возможного».
Учитель напоминает, что понятие «доля» имеет универсальный характер - она показывает, с какой частью от целого ведутся расчеты, - и напоминает разновидности этого понятия, с которыми оперировали учащиеся в прошлом году: доля элемента в соединении, массовая или объемная доля компонента в смеси веществ.
Теперь, продолжает учитель, познакомимся с долей выхода продукта реакции от теоретически возможного и предлагает решить задачу:
«Найдите объем углекислого газа (н. у.), который можно получить взаимодействием 250 г известняка, содержащего 20% примесей, с избытком азотной кислоты».
Учащиеся легко справляются с задачей, повторяя алгоритм решения расчетов по химическим уравнениям:

Учитель ставит проблему: можно ли на самом деле (на практике) получить рассчитанный теоретический объем? Ведь технология получения химической продукции часто оставляет желать лучшего. И демонстрирует взаимодействие кусочка мрамора с кислотой, а также собирание СО 2 в колбу. Ученики без труда догадываются, что собранный объем продукта всегда будет меньше рассчитанного: часть его потеряется, пока учитель закроет прибор пробкой, часть улетучится, пока конец газоотводной трубки опустят в колбу, и т. д.
Учитель обобщает, что отношения объема (или массы) полученного продукта - практический выход к объему (или массе) рассчитанного теоретически и называется долей выхода - ω вых. или W:
Затем учитель просит найти объем СО 2 для рассмотренной задачи, если выход его равен 75% от теоретически возможного:
На дом предлагается обратная задача:
«При взаимодействии 800 мг 30%-ного раствора едкого натра (гидроксида натрия) с избытком раствора медного купороса (сульфата меди (И)) было получено 196 мг осадка. Каков его выход в процентах от теоретически возможного?»
IV. Генетический ряд металла
В заключение урока учащиеся вспоминают признаки генетического ряда металла:
1) один и тот же химический элемент-металл;
2) разные формы существования этого химического элемента: простое вещество и соединения - оксиды, основания, соли;
3) взаимопревращения веществ разных классов.
В итоге учащиеся записывают генетический ряд лития:

который учитель предлагает дома проиллюстрировать уравнениями реакций в ионной (там, где это имеет место) и молекулярной формах, а также разобрать все окислительно-восстановительные реакции.
Запишем уравнения окисления лития и натрия избытком кислорода:4Li + O 2 = 2Li 2 O (1);
2Na + O 2 = Na 2 O 2 (2).
Найдем суммарное количество вещества кислорода:
n(O 2) = V(O 2) / V m ;
n(O 2) = 3,92 / 22,4 = 0,175 моль.
Пусть на окисление лития было израсходовано х моль кислорода, тогда в реакции окисления натрия участвовало (0,175 — х) моль кислорода.
Обозначим количество вещества лития как «а», а натрия - «b», тогда, согласно записанным выше уравнениям реакции:
b = 2 ×(0,175 — х) = 0,35 - 2х.
Найдем массы лития и натрия (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел — Ar(Li) = 7 а.е.м.; Ar(Na) = 23а.е.м.):
m(Li) = 4х × 7 = 28х (г);
m(Na) = (0,35 - 2х)× 23 = 8,05 — 46х (г).
Учитывая, что масса смеси лития и натрия была равна 7,6 г можно записать уравнение:
28х + (8,05 — 46х) = 7,6;
(-18)× х = -(0,45);
Следовательно, количество вещества кислорода,израсходованное на окисление лития равно 0,025 моль, а натрия - (0,175 - 0,025) = 0,15 моль.
По уравнению (1) n(O 2) :n(Li 2 O) = 1: 2, т.е.
n(Li 2 O) = 2×n(O 2) = 2×0,025 = 0,05 моль.
Согласно уравнению (2) n(O 2) :n(Na 2 O 2) = 1: 1, т.е. n(Na 2 O 2)=n(O 2)= 0,15 моль.
Запишем уравнения реакции растворения продуктов окисления лития и натрия в серной кислоте:
Li 2 O + H 2 SO 4 = Li 2 SO 4 + H 2 O (3);
2Na 2 O 2 + 2H 2 SO 4 = 2Na 2 SO 4 + 2H 2 O + O 2 (4).
Рассчитаем массу серной кислоты в растворе:
m solute (H 2 SO 4) = m solution (H 2 SO 4) ×w(H 2 SO 4) / 100%;
m solute (H 2 SO 4) = 80 × 24,5 / 100% = 19,6 г.
Количество вещества серной кислоты будет равно (молярная масса - 98 г/моль):
n (H 2 SO 4) = m (H 2 SO 4) / M (H 2 SO 4);
n (H 2 SO 4) = 19,6 / 98 = 0,2моль.
Определим число молей продуктов реакций (3) и (4). Согласно уравнению (3) n(Li 2 O) :n(Li 2 SO 4) = 1: 1, т.е. n(Li 2 O) = n(Li 2 SO 4) = 0,05 моль. По уравнению (4) n(Na 2 O 2) :n(Na 2 SO 4) = 2: 2, т.е. n(Na 2 O 2) =n(Na 2 SO 4) = 0,15 моль.
Найдем массы образовавшихся сульфатов (М(Li 2 SO 4) = 110 г/моль; М(Na 2 SO 4) = 142 г/моль):
m(Li 2 SO 4) = 0,05 × 110 = 5,5 (г);
m(Na 2 SO 4) = 0,15 × 142 = 21,03 (г).
Чтобы рассчитать массовые доли полученных веществ, необходимо найти массу раствора. В него входят серная кислота, оксид лития и пероксид натрия. Необходимо учесть массу кислорода, который выделяется из реакционный смеси, в ходе реакции (4). Определим массы оксида лития и пероксида натрия (М(Li 2 O) = 30 г/моль, М(Na 2 O 2) = 78 г/моль):
m(Li 2 O) = 0,05 ×30 = 1,5 (г);
m(Na 2 O 2) = 0,15 ×78 = 11,7 (г).
Согласно уравнению (4) n(O 2) :n(Na 2 O 2) = 1: 2, т.е.
n(O 2) = ½ ×n(Na 2 O 2) = ½ × 0,15 = 0,075 моль.
Тогда масса кислорода будет равна (М(O 2) = 32 г/моль):
m(O 2) = 0,075 × 32 = 2,4 (г).
Для того, чтобы найти массу итогового раствора необходимо определить осталась ли в растворе серная кислота. Согласно уравнению (3) n(Li 2 O):n(H 2 SO 4) = 1: 1, т.е. n(H 2 SO 4) = n(Li 2 O) = 0,05 моль. По уравнению (4) n(Na 2 O 2) :n(H 2 SO 4) = 2: 2, т.е. n(H 2 SO 4) = n(Na 2 O 2) = 0,15 моль.Таким образом в реакцию вступило (0,05 + 0,15) = 0,2 моль серной кислоты, т.е. она прореагировала полностью.
Рассчитаем массу раствора:
m solution = m(Li 2 SO 4) + m(Na 2 SO 4) — m(O 2);
m solution = 5,5 + 21,03 — 2,4 = 24,13 г.
Тогда, массовые доли сульфатов натрия и лития в растворе будут равны:
w(Li 2 SO 4) = m(Li 2 SO 4) /m solution × 100%;
w(Li 2 SO 4) = 5,5 /24,13× 100% = 22,79%.
w(Na 2 SO 4) = m(Na 2 SO 4) /m solution × 100%;
w(Na 2 SO 4) = 21,03 / 24,13 × 100% = 87,15%.
Домашнее задание №3
Дать характеристику элементов P (фосфор) и K (калий) по плану:
Характеристика элемента по плану:
Положение элемента в периодической системе. Период, группа, подгруппа.
Порядковый номер, заряд ядра, количество протонов, количество электронов, количество нейтронов.
Электронное строение атома. Электронные формулы (полная, сокращённая, электронно-графическая) с учётом возможных возбуждённых состояний. Тип элемента (s, p, d, f).
Возможные валентные состояния атома.
Металл, неметалл, амфотерный металл.
Высший оксид элемента, его характер.
Гидроксид элемента, его характер.
Пример формул солей.
Водородные соединения.
Примерный
ответ.
Характеристика
химического элемента-металла по его
положению в периодической системе на
примере лития.
Литий
― это элемент 2 периода главной подгруппы
I группы периодической системы Д. И.
Менделеева, элемент IA или главной
подгруппы (подгруппы щелочных металлов).
Строение атома лития можно отразить
так: №3 Li: протонов р + =3,
электронов ē=3 (Li ― 2ē, 1ē), нейтронов n 0 =4
(А-р +) Тип
элемента-S.
Электронная формула: 1s 2 2s 1
Атомы лития будут проявлять сильные
восстановительные свойства: легко
отдадут свой единственный внешний
электрон и получат в результате степень
окисления (с. о.) +1. Эти свойства атомов
лития будут слабее выражены, чем у атомов
натрия, что связано с увеличением
радиусов атомов: R (Li) Литий ―
простое вещество, представляет собой
металл, а, следовательно, имеет
металлическую кристаллическую решетку
и металлическую химическую связь. Заряд
иона лития: не Li +1
(так указывают с. о.), а Li + .
Общие физические свойства металлов,
вытекающие из их кристаллического
строения: электро- и теплопроводность,
ковкость, пластичность, металлический
блеск и т. д.
Литий образует оксид с
формулой Li 2 O
― это солеобразующий, основной оксид.
Это соединение образовано за счет ионной
химической связи Li 2 + O 2- ,
взаимодействуют с водой, образуя щелочь.
Гидроксид лития имеет формулу LiOH. Это
основание ― щелочь. Химические свойства:
взаимодействие с кислотами, кислотными
оксидами и солями.
В подгруппе щелочных
металлов отсутствует общая формула
"Летучие водородные соединения".
Эти металлы не образуют летучих водородных
соединений. Соединения металлов с
водородом ― бинарные соединения ионного
типа с формулой M + H - .
Химический элемент Литий получил известность благодаря открытию Иоганна Августа Арфведсона в 1817 г в составе алюмосиликата, петалита. Затем «огнепостоянную щёлочь» нашли в других минералах естественного происхождения. Это белый, с серебристым блеском металл, который можно разрезать ножом. В таблице Менделеева занимает третье место и обозначается Li (от латинского Lithium).
Краткое описание химического элемента Литий
Порядковый (атомный) номер элемента в периодической системе химических элементов Менделеева равен трём. В обычных условиях металлический Li обладает самой низкой плотностью из всего числа известных металлов. Кроме того, он возглавляет семейство щелочных металлов по температуре плавления и кипения.
Исторические факты
Первый металлический образец был получен сэром Гемфри Дэви в процессе разложения электрическим током расплава гидроксида лития. Вместе с первым результатом электролиза лития, Леопольд Гмелин, экспериментируя с литий содержащими солями, отметил окрашивание пламени в тёмно-карминовый цвет.
Химические свойства лития
Литий проявляет «капризные» свойства при смешивании с натрием, совсем не реагирует с расплавами калия , рубидия и цезия. В условиях комнатной температуры литий не взаимодействует с сухим воздухом или водородом . В отличие от остальных щелочных металлов, его невозможно хранить в керосине. Для данной цели используют масло Шервуда, парафин, газовый бензин или минеральное масло в герметичных жестяных ёмкостях.
При температуре выше 100, но ниже 300 градусов цельсия, на поверхности лития образуется защитная оксидная плёнка, препятствующей дальнейшему взаимодействию хим. Элемента с окружающей средой, даже во влажном воздухе. Металлическая форма элемента обжигает при попадании на влажную поверхность кожи или слизистой.
Применение лития
Сам элемент и его соединения широко применяются для производства стекла, в качестве покрытия фарфора. Чёрная и цветная металлургия используют литий для придания сплавам прочности и пластичности, в изготовлении смазок. Текстильная промышленность применяет этот элемент в качестве отбеливателя тканей, пищевая – в роли консерванта, фармацевтика успешно использует в косметических препаратах.
Жидкий литий нашёл своё применение в ядерных реакторах, радиоактивный тритий получают при помощи изотопа лития-6. Широкое применение щелочной металл нашёл в химической промышленности, как катализатор многих процессов, компонент сплавов, из которых изготавливают холодные катоды, а также аноды источников тока.
Фторид лития в виде монокристаллов применяют для создания высокоточных лазеров с КПД 80%. Различные соединения с литием участвуют в дефектоскопии, пиротехнике, радиоэлектронике, оптоэлектронике.
Соли лития – психотропное вещество, положительное влияние которых на психическое состояние человека было подтверждено лишь в середине XX века. Карбонат лития с успехом применяется для лечения людей с биполярным расстройством, маниакальной депрессией, склонных к суициду.
Этим объясняется низкий уровень преступности в тех районах, где в значительной степени литий содержится в питьевой воде. Механизм воздействия элемента до сих пор изучен слабо, но существуют предположения, что положительный эффект достигается регулятивной функцией активности части ферментов, участвующих в переносе ионов натрия и калия в мозг. Баланс Na и К напрямую отвечает за состояние психики. Так доказано, что у людей, склонных к депрессии, в клетках избыточное содержание натрия, а литий выравнивает ионную картину.
Свойство лития уменьшать депрессию и риск суицида нашло свое отражение в творчестве групп Nirvana и Evanescence. В их дискографии имеются психоделические песни под названием Lithium.
На роли лития в активизации спящих клеток костного мозга основана надежда современной медицины в деле борьбы с раком крови. Экспериментально доказано, что литий благоприятно воздействует на области поражения генитальным герпесом. Положительно отмечено применения Li в комплексе лечения гипертонии и диабета. Безусловна эффективность в рамках предупреждения склероза и заболеваний сердечно-сосудистой системы.
Присутствуя в смазочных материалах, литий позволяет осваивать Антарктиду, в условиях критически низких температур. Без этого элемента техника попросту откажет. Его рассматривают как компонент твёрдого ракетного топлива, ведь результат сгорания 1 кг твёрдого Li более десяти тысяч килокалорий, что почти в пять раз больше, чем результат сгорания 1 кг керосина.